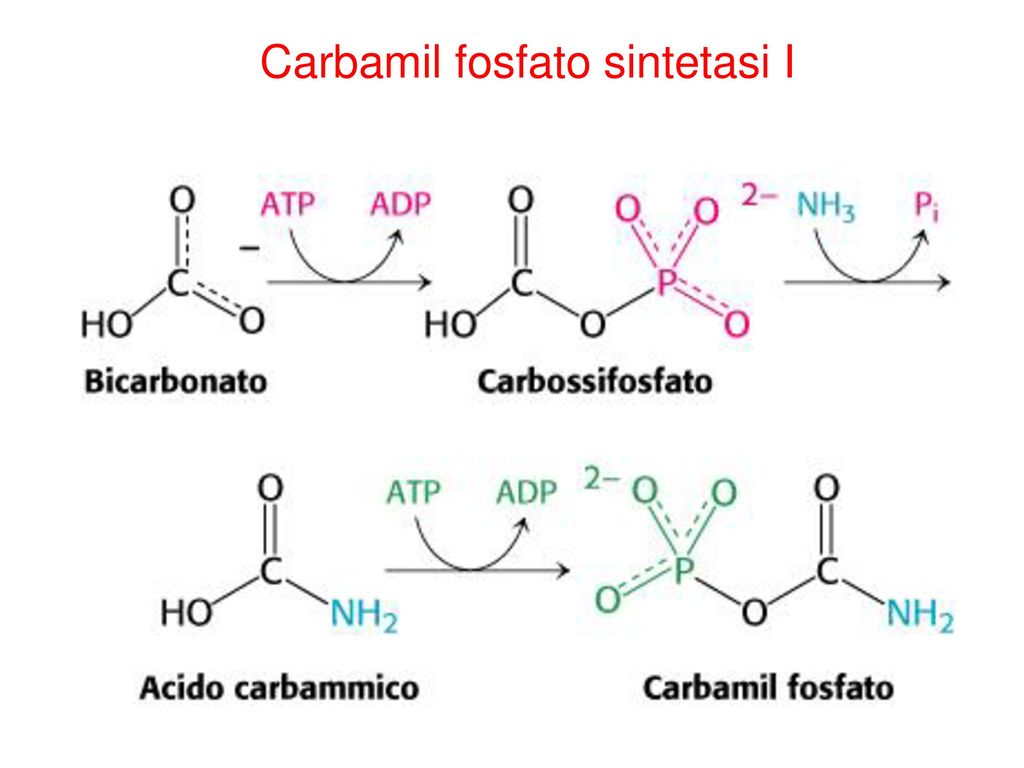
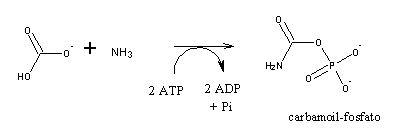La carbamoil fosfato sintetasa cataliza la síntesis dependiente de ATP de carbamoil fosfato a partir de glutamina EC (6.3.5.5 )[1] o amoniaco (EC 6.3.4.16) y bicarbonato.[2] Esta enzima cataliza la reacción de ATP y bicarbonato para producir carboxifosfato y ADP. El carboxifosfato reacciona con el amoníaco para dar ácido carbámico. A su vez, el ácido carbámico reacciona con un segundo ATP para dar carbamoil fosfato más ADP.
Representa el primer paso comprometido en la biosíntesis de pirimidina y arginina en procariotas y eucariotas, y en el ciclo de la urea en la mayoría de vertebrados terrestres.[3] La mayoría de procariotas llevan una forma de CPSasa que participa tanto en la biosíntesis de arginina como de pirimidina, sin embargo ciertas bacterias pueden tener formas separadas.
Existen tres formas diferentes que desempeñan funciones muy distintas:
- Carbamoil fosfato sintetasa I (mitocondria, ciclo de la urea)
- Carbamoil fosfato sintetasa II (citosol, metabolismo de la pirimidina).
- Carbamoil fosfato sintetasa III (en los peces).[4]
Mecanismo
La carbamoil fosfato sintetasa tiene tres pasos principales en su mecanismo y es, en esencia, irreversible.[5]
- El ion bicarbonato se fosforila con ATP para crear carboxilfosfato.
- A continuación, el carboxifosfato reacciona con el amoníaco para formar ácido carbámico, liberando fosfato inorgánico.
- A continuación, una segunda molécula de ATP fosforila el ácido carbámico, creando carbamoilfosfato.
Se sabe que la actividad de la enzima es inhibida por los tampones Tris y HEPES.[6]
Estructura
La carbamoil fosfato sintasa (CPSasa) es una enzima heterodimérica compuesta por una subunidad pequeña y una grande (a excepción de la CPSasa III, que está compuesta por un único polipéptido que puede haber surgido de la fusión génica de los dominios glutaminasa y sintetasa).[3][4][7] La CPSasa tiene tres sitios activos, uno en la subunidad pequeña y dos en la subunidad grande. La subunidad pequeña contiene el sitio de unión de la glutamina y cataliza la hidrólisis de la glutamina a glutamato y amoníaco, que a su vez es utilizado por la cadena grande para sintetizar carbamoil fosfato. La subunidad pequeña tiene una estructura de 3 capas beta/beta/alfa, y se cree que es móvil en la mayoría de las proteínas que la portan. El dominio C-terminal de la subunidad pequeña de la CPSasa tiene actividad glutamina amidotransferasa. La subunidad grande tiene dos dominios carboxifosfato homólogos, ambos con sitios de unión a ATP; sin embargo, el dominio carboxifosfato N-terminal cataliza la fosforilación del biocarbonato, mientras que el dominio C-terminal cataliza la fosforilación del intermedio carbamato.[8] El dominio carboxifosfato que se encuentra duplicado en la subunidad grande de la CPSasa también está presente como copia única en las enzimas dependientes de biotina acetil-CoA carboxilasa (ACC), propionil-CoA carboxilasa (PCCasa), piruvato carboxilasa (PC) y urea carboxilasa.
La subunidad grande de la CPSasa bacteriana tiene cuatro dominios estructurales: el dominio carboxifosfato 1, el dominio de oligomerización, el dominio carbamoilfosfato 2 y el dominio alostérico.[9] Los heterodímeros de la CPSasa de Escherichia coli contienen dos túneles moleculares: un túnel de amoníaco y un túnel de carbamato. Estos túneles interdominio conectan los tres sitios activos distintos, y funcionan como conductos para el transporte de intermediarios de reacción inestables (amoníaco y carbamato) entre sitios activos sucesivos.[10] El mecanismo catalítico de la CPSasa implica la difusión de carbamato a través del interior de la enzima desde el sitio de síntesis dentro del dominio N-terminal de la subunidad grande hasta el sitio de fosforilación dentro del dominio C-terminal.
Referencias
Enlaces externos
- GeneReviews/NCBI/NIH/UW entry on Urea Cycle Disorders Overview
Este artículo incorpora texto del dominio público de Pfam e InterPro: IPR005479
Este artículo incorpora texto del dominio público de Pfam e InterPro: IPR005480
Este artículo incorpora texto del dominio público de Pfam e InterPro: IPR005481
Este artículo incorpora texto del dominio público de Pfam e InterPro: IPR002474